Vsebina
- TL; DR (Predolgo; Nisem prebral)
- Razvrstitev propana
- Kemična formula propana
- Propanska struktura
- Lastnosti propana
- Uporaba propana
Propan je fosilno gorivo in sestavni del zemeljskega plina. Skozi milijone let se je oblikoval iz organskih ostankov organizmov in se pridobiva iz podzemnih nahajališč. Plin propan je organska spojina, sestavljena iz treh molekul ogljikovih atomov, povezanih z osmimi vodikovimi atomi. Vrsta vezi ogljik-ogljik ogljik-vodik določa strukturo molekul propana, ki sledi enakemu vzorcu kot druge vrste naravnih plinov, kot sta metan in butan.
TL; DR (Predolgo; Nisem prebral)
TL; DR (Predolgo; Nisem prebral)
Kemična formula propana je C3H8.
Razvrstitev propana
Propan je razvrščen kot organska spojina, ker vsebuje ogljik. Nadalje je uvrščen med ogljikovodike, ker spada v skupino organskih spojin, ki so sestavljene iz le ogljika in vodika. Natančneje, propan je vrsta ogljikovodika, ki se imenuje alkan. Atome v molekulah alkana držijo skupaj enojne kovalentne vezi, ogljikovi atomi pa vedno tvorijo štiri kovalentne vezi.
Kemična formula propana
Alkani sledijo splošni formuli z nastavljenim razmerjem ogljikovih atomov do vodikovih atomov: C_nH2_n+2. Najpreprostejši alkan je metan, sicer znan kot zemeljski plin. Vsebuje en atom ogljika, vezan na štiri vodikove atome. Za metan oz. n = 1, torej je število njegovih vodikovih atomov enako 2 (1) +2, kar je enako 4. Etan vsebuje dva ogljikova atoma, povezana skupaj, vsak ogljik pa je vezan na tri vodikove atome, skupaj šest atomov vodika. Propan ima verigo s tremi ogljikovimi atomi s kemijsko formulo C3H8, ker veriga treh ogljikov zahteva 2 (3) +2 atoma vodika, kar je osem. Butan, še en pogost alkan, ki se uporablja kot gorivo v ročnih plinskih baklah, ima štiri ogljikove atome, vezane z desetimi vodikovimi atomi, s kemijsko formulo C4H10.
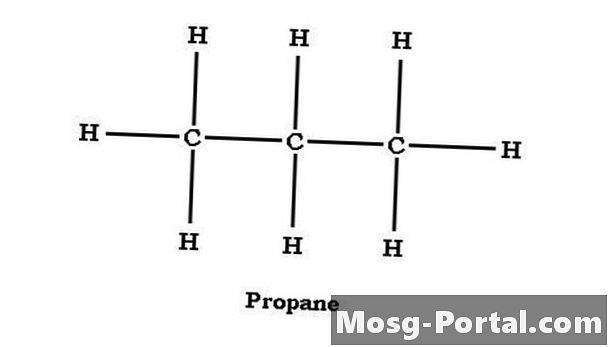
Propanska struktura
Alkani so lahko strukturirani kot ravna ali razvejena veriga. Propan je ravnoveren alkan z ogljikovimi atomi, strukturiran C-C-C. Srednji ogljik deli eno vez z vsakim končnim ogljikom in ima dva vodikova atoma. Vsak končni ogljik si deli vez z osrednjim atomom ogljika in je vsak vezan s tremi vodikovimi atomi. Propan lahko glede na posamezne atome ogljika izrazimo kot CH3CH2CH3, kar je enako C3H8 vendar naredi strukturo propana bolj nazorno.
Lastnosti propana
Poleg strukturnih podobnosti, ki jih delijo ravnoverižni alkani, imajo tudi podobne lastnosti. Propan in drugi ogljikovodiki so nepolarni. Ta lastnost narekuje, da se lahko mešajo le z drugimi nepolarnimi snovmi. Na primer, olja in druga goriva so narejena iz mešanice ogljikovodikov. Ne bodo se mešali s polarno snovjo, kot je voda; privlačnost med molekulama ločuje olje in vodo. Z ravnimi alkani se vrelišče in tališče povečujeta, kolikor se poveča število molekul ogljika. Temperatura vrelišča propana je −44 stopinj Farenhejta (−42 stopinj Celzija), taljenje pa -306 stopinj Farenhejta (−189 stopinj Celzija). Metan z le enim ogljikom ima nižje vrelišče kot propan pri -164 stopinjah Celzija. Oktan ima osem ogljika in vrelišče 98 stopinj Celzija.
Uporaba propana
Propan je zaradi nizkega vrelišča običajno v plinastem stanju. Ko na propan določimo pravilno količino tlaka in temperature, gre skozi postopek, imenovan utekočinjanje, ki sili propan v tekoče stanje. Propan je mogoče shraniti kot tekočino v rezervoarjih pod tlakom precej nad vreliščem. Utekočinjeni propanski plin se uporablja kot ogrevalno gorivo, ki se kuri na električne peči in grelnike tople vode. Uporablja se tudi kot kuhalno gorivo za zunanje plinske žare in kaminske peči na plin. Propanski plin je tudi sestavni del pogonskih goriv, ki se uporabljajo v aerosolnih pločevinkah. Propan se uporablja tudi kot sestavni del pri nekaterih vrstah lepil, tesnilnih mas in barv.