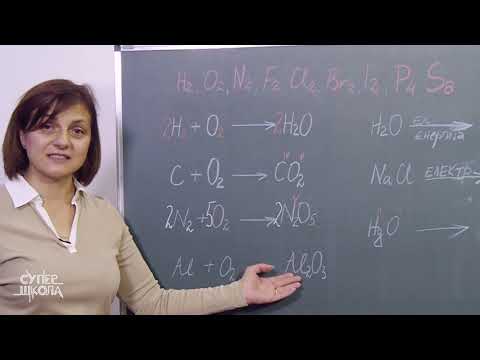
Vsebina
Sinteza je ena od štirih glavnih vrst kemijskih reakcij in nastane, ko se dve ali več snovi - bodisi elementi ali spojine - združijo, da nastane nova spojina. To pomeni, da reakcija vključuje več kot en reaktant in na splošno samo en izdelek, ki vsebuje vsak element reaktantov. Mnogo pomembnih kemijskih reakcij so sintezne reakcije.
Sinteza kovinskih oksidov
Pomembna reakcija sinteze, ki se dogaja v naravi, je kovina in molekula kisika, da nastane kovinski oksid. Ta reakcija je tudi oksidacijska reakcija in je prvi korak v koroziji kovine. Ker je kisik naravni sestavni del zraka, reagira z zgornjo površino kovin in tvori novo plast kovinskega oksida. Za boj proti temu pojavu so nekateri materiali izdelani z zaščitno plastjo kovinskega oksida, ki že prevleče površino. En primer sinteze kovinskega oksida je 2Mg + O2 -> 2MgO, v katerem magnezij reagira s kisikom, da ustvari magnezijev oksid.
Sinteza kovinskih hidroksidov
Drugi korak v postopku korozije je tudi sintezna reakcija. V tem koraku kovinski oksid reagira z vodo in tvori kovinski hidroksid. Najbolj znana reakcija te vrste je tvorba rje. Ko je železo reagiralo z molekulo kisika, novo nastali železov oksid reagira z vodo, da dobimo hidriran železov oksid, kar je drugo ime za rjo. Drugi primer je reakcija magnezijevega oksida z vodo, da nastane magnezijev hidroksid, ki ga dobimo z enačbo MgO + H2O -> Mg (OH) 2.
Sinteza soli
Sol so ionske spojine, ki nastanejo, ko se element s skrajne leve strani periodične tabele - glavna skupina kovin - združi z nemetali s skrajne desne strani periodične tabele. Na primer, enačba 2Na + Cl2 -> 2NaCl predstavlja reakcijo natrija in klorida, da nastane sol natrijev klorid. Ta reakcija se lahko zgodi, ko je natrij v trdnem stanju s klorovim plinom, vendar se podobna reakcija zgodi, ko se natrij in klor raztopita v vodi. V tem primeru so reaktanti ioni in enačba je Na + + Cl- -> NaCl.
Sinteza amoniaka
Sinteza amoniaka je pomembna reakcija, katere enačba je N2 + 3H2 -> NH3. Amoniak je pomemben, ker se uporablja v gnojilih, vendar je reakcijo sinteze razvil Fritz Haber - zato je med drugo svetovno vojno znan tudi kot Haberjev proces - za izdelavo eksploziva. Haber je bil nemški kemik z dvomljivim naslovom, "oče kemične vojne". Haber postopek mora potekati pri visokem tlaku in temperaturi in zahteva katalizator, snov, ki poveča hitrost reakcije, ne da bi bil dejansko sam reaktant.