Vsebina
V kemijski reakciji se začetni materiali, imenovani reaktanti, pretvorijo v produkte. Medtem ko vse kemijske reakcije zahtevajo začetni vnos energije, ki se imenuje aktivacijska energija, nekatere reakcije povzročijo neto sproščanje energije v okolico, druge pa neto absorpcijo energije iz okolice. Slednje stanje imenujemo endergonska reakcija.
Reakcijska energija
Kemiki svojo reakcijsko posodo definirajo kot "sistem", vse ostalo v vesolju pa kot "okolico". Zato, ko endergonska reakcija absorbira energijo iz okolice, energija vstopi v sistem. Nasproten tip je eksergonična reakcija, pri kateri se energija sprosti v okolico.
Prvi del vsake reakcije vedno zahteva energijo, ne glede na vrsto reakcije. Čeprav sežig lesa oddaja toploto in se spontano pojavi, ko se začne, morate postopek začeti z dodajanjem energije. Plamen, ki ga dodate za zagon kurjenja lesa, zagotavlja aktivacijsko energijo.
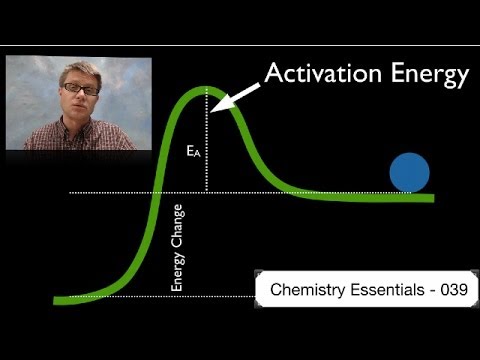
Aktivacijska energija
Če pridete od reakcijske strani do produktne strani kemijske enačbe, morate premagati oviro aktivacijske energije. Vsaka posamezna reakcija ima značilno velikost pregrade. Višina pregrade nima nobene zveze s tem, ali je reakcija endergonična ali eksergonična; na primer, lahko ima ekstrogonična reakcija zelo visoko aktivacijsko energijsko oviro ali obratno.
Nekatere reakcije potekajo v več korakih, pri čemer ima vsak korak svojo aktivacijsko energijsko oviro, ki jo je treba premagati.
Primeri
Sintetične reakcije so ponavadi endergonične, reakcije, ki razgrajujejo molekule, pa so eksergonične. Na primer, postopek združevanja aminokislin, da nastane beljakovina, in tvorba glukoze iz ogljikovega dioksida med fotosintezo sta endergonični reakciji. To je smiselno, saj verjetno procesi, ki gradijo večje strukture, zahtevajo energijo. Povratna reakcija - na primer celično dihanje glukoze v ogljikov dioksid in vodo - je ekstrogonski proces.
Katalizatorji
Katalizatorji lahko zmanjšajo aktivacijsko energijsko oviro reakcije. To storijo tako, da stabilizirajo vmesno strukturo, ki obstaja med molekulo reaktanta in produkta, kar pretvorbo olajša. V bistvu katalizator daje reaktantom nižji energijski "tunel", skozi katerega je lažje priti do produktne strani aktivacijske energetske ovire. Obstaja veliko vrst katalizatorjev, nekateri najbolj znani pa so encimi, katalizatorji sveta biologije.
Spontanost reakcije
Ne glede na aktivacijsko energijsko oviro se spontano pojavijo le ekstgonicne reakcije, ki oddajajo energijo. Kljub temu moramo še vedno zgraditi mišice in popraviti svoje telo, kar je oba endergonična procesa. Endergonski proces lahko poganjamo tako, da ga povežemo z eksergoničnim postopkom, ki zagotavlja dovolj energije, da se ujema z energijsko razliko med reaktanti in produkti.