
Vsebina
- TL; DR (Predolgo; Nisem prebral)
- Kako izračunati molove
- Pretvarjanje v Mmol
- Koncentracija raztopine
- Primer
Kemiki so zaradi preprostega izračuna izračunali standardno enoto za število atomov določene spojine, ki je vključena v reakcijo ali kakšen drug kemični postopek. En mol (mol) definirajo kot količino katere koli snovi, ki ima enako število osnovnih enot kot 12 gramov ogljika-12, kar je Avogadros število (6.022 × 1023). SI (metrični) merilni sistem definira milimole (Mmol) kot tisočinko mola. Na splošno izračunamo število molov snovi s tehtanjem količine, ki jo imate na voljo. Če želite pretvoriti v Mmol, pomnožite z 103 (1,000).
TL; DR (Predolgo; Nisem prebral)
En mol je enak Avogadros številu delcev določene spojine. Milimola (Mmol) je ena tisočina mola.
Kako izračunati molove
Atomske mase se merijo v atomskih masnih enotah (AMU). Ena AMU je natančno 1/12 mase jedra atoma ogljika-12 v njegovem osnovnem stanju. En mol snovi je opredeljen tako, da je enak Avogadros številu delcev te snovi. Po tej definiciji je teža enega mola snovi v gramih enaka masi posameznega delca te snovi v AMU. Na primer, atomska teža ogljika-12 znaša 12 AMU, zato en mol ogljika-12 tehta 12 gramov.
Razmislite o posodi, polni vodikovega plina (H2). Vsak delček v posodi je molekula, sestavljena iz dveh vodikovih atomov, zato morate za izračun molekulske mase poznati le atomsko maso vodika. Večina različic občasne tabele navaja atomsko maso vsakega elementa pod njegovim simbolom. Za vodik, ki ima v jedru en sam proton, 1.008 AMU, kar je povprečje vseh naravnih izotopov vodika. Posledično je atomska masa vodikovega plina 2.016 AMU, en mol vodikovega plina pa tehta 2.016 gramov. Če želite najti število molov v vašem vzorcu, bi vzorec stehtali v gramih in to maso razdelili na molekulsko maso vodikovega plina v gramih. Na primer, vzorec, ki tehta 15 gramov čistega vodikovega plina, vsebuje 7,44 molov.
Pretvarjanje v Mmol
Včasih so količine v preiskavi tako majhne, da jih je izražanje v molih okorno. Vnesite milimole. Če pomnožite število molov na tisoč, lahko zelo majhno število pretvorite v bolj obvladljivega. To je še posebej priročno pri obravnavi enot volumna v vrstnem redu mililitrov.
1 mol = 1.000 Mmol
Koncentracija raztopine
Kemiki uporabljajo molarnost kot merilo koncentracije določene spojine v raztopini. Molarnost definirajo kot število molov na liter. Molarnost pretvorite v milimolarnost tako, da pomnožite s 1.000. Na primer, raztopina 1 mol (molarna, napisana tudi kot M) ima koncentracijo 1 mol na liter. To je ekvivalentno raztopini 1.000 Mmol (milimolarna, včasih napisana tudi kot mM), ki vsebuje 1.000 Mmol na liter.
Primer
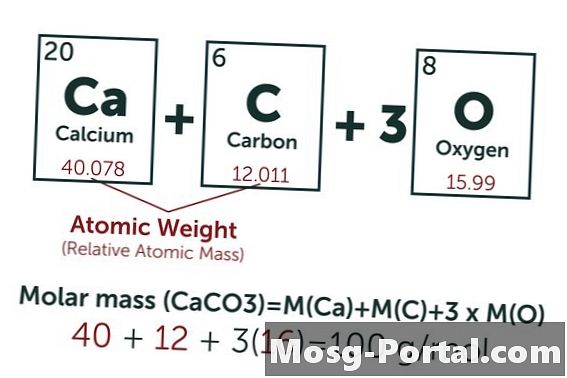
Raztopina vsebuje 0,15 grama kalcijevega karbonata. Koliko milimolov je to?
Kemična formula kalcijevega karbonata je CaCO3. Atomska teža ogljika (C) je približno 12 AMU, masa kisika (O) približno 16 AMU in kalcija (Ca) približno 40 AMU. Vsaka molekula kalcijevega karbonata tako tehta 100 AMU, kar pomeni, da en mol tehta približno 100 gramov. Teža 0,15 grama predstavlja 0,15 g ÷ 100 g / mol = 0,0015 molov. To je enako 1,5 Mmol.
Kakšna je molarnost in milimolarnost tega veliko kalcijevega karbonata v 2,5 litra raztopine?
Molarnost je opredeljena kot število molov na liter, zato število molov delite s 2,5, da dobite molarnost: 0,0015 ÷ 2,5 =
0.0006 M
Pomnožite z 1.000, da dobite milimolarnost =
0,6 mM
Upoštevajte, da dobite enak rezultat za milimolarnost, če delite število milimolov na prostornino raztopine.